
陆军军医大学陆军特色医学中心(大坪医院)骨科刘鹏副教授联合解放军总医院第五医学中心刘兵研究员,在陆军特色医学中心(大坪医院)陈林教授课题组的支持下,在椎间盘再生医学领域取得重要进展。研究成果以“Spatially-defined single-cell transcriptional profiling uncovers diversified chondrocyte subtypes and nucleus pulposus progenitors in human intervertebral disc(空间界定的人类椎间盘单细胞图谱解析多种软骨细胞亚群和髓核祖细胞)” 为题,于2021年8月16日在《骨研究》(Bone Research)杂志上发表封面论文。
论文链接:https://www.nature.com/articles/s41413-021-00163-z。
椎间盘退行性疾病(degenerative disc disease, DDD)是引起颈肩痛与腰腿痛的主要原因,严重影响患者的生活质量,给家庭和社会造成了沉重的负担。因此,人们不断深入探索椎间盘生理学和病理学机制,寻求重建椎间盘稳态的创新治疗方法。然而,椎间盘细胞的高度异质性以及微环境的高度复杂性为椎间盘退变生理病理机制的探索带来了重大挑战。以往研究发现,人类椎间盘具有细胞多样性,且与多种生理功能有关。例如,椎间盘干细胞可能在椎间盘发育、损伤和修复过程中发挥关键作用。但迄今为止仍缺乏精确识别人类椎间盘内各细胞亚群的细胞图谱,各细胞亚群的起源、分子特征及其调控机制也亟需研究。
为回答这一基础科学问题,研究人员对108,108个椎间盘髓核、纤维环及终板组织的细胞分别进行了单细胞转录组测序和分析,在世界上首次系统绘制了人类椎间盘的单细胞图谱,实现了对椎间盘细胞异质性的全新认识,并根据对细胞外基质稳态的作用对软骨细胞亚群进行了重新分类,并结合体外功能实验发现了一群定位于髓核内部、特征性表达PDGFRA和PROCR的髓核祖细胞(nucleus pulposus progenitor cells, NPPC),并揭示该细胞具有集落形成和三系分化能力。该工作是国际上首次针对人类椎间盘细胞异质性的系统研究,对于深入理解人类椎间盘发育及退变机制具有重要意义。
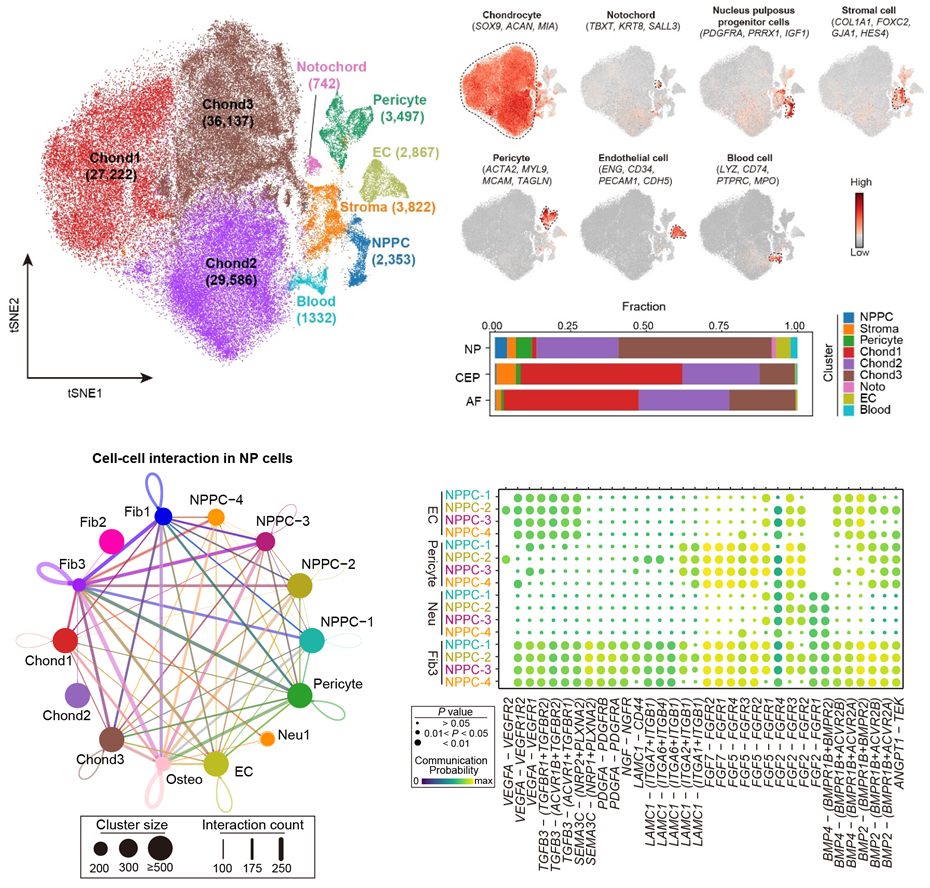
研究人员从13-31周岁的研究人群中获得健康椎间盘(Pfirrmann I级),从中分离髓核、纤维环和终板组织,分别进行高通量单细胞转录组测序,通过整合分析鉴定得到9个主要细胞亚群,包括:3群软骨细胞亚群、脊索细胞、基质细胞、周细胞、内皮细胞、祖细胞及血细胞,并利用已知基因标志物解析了其在椎间盘的空间分布情况以及转录调控特征。其中,3群软骨细胞进一步细分为调控型、稳态型和效应型。调控型软骨细胞主要在细胞因子表达和软骨生成相关调控通路中发挥调控作用;稳态型软骨细胞亚群相对静息并且分化完全,高度表达与基质合成和节律调节相关的基因;效应型软骨型细胞具有高代谢活性并且高表达发挥软骨保护因子PRG4。软骨细胞亚群在胞外基质稳态维持功能中的异质性,为进一步探索椎间盘软骨细胞的机制提供了一个新的视角。
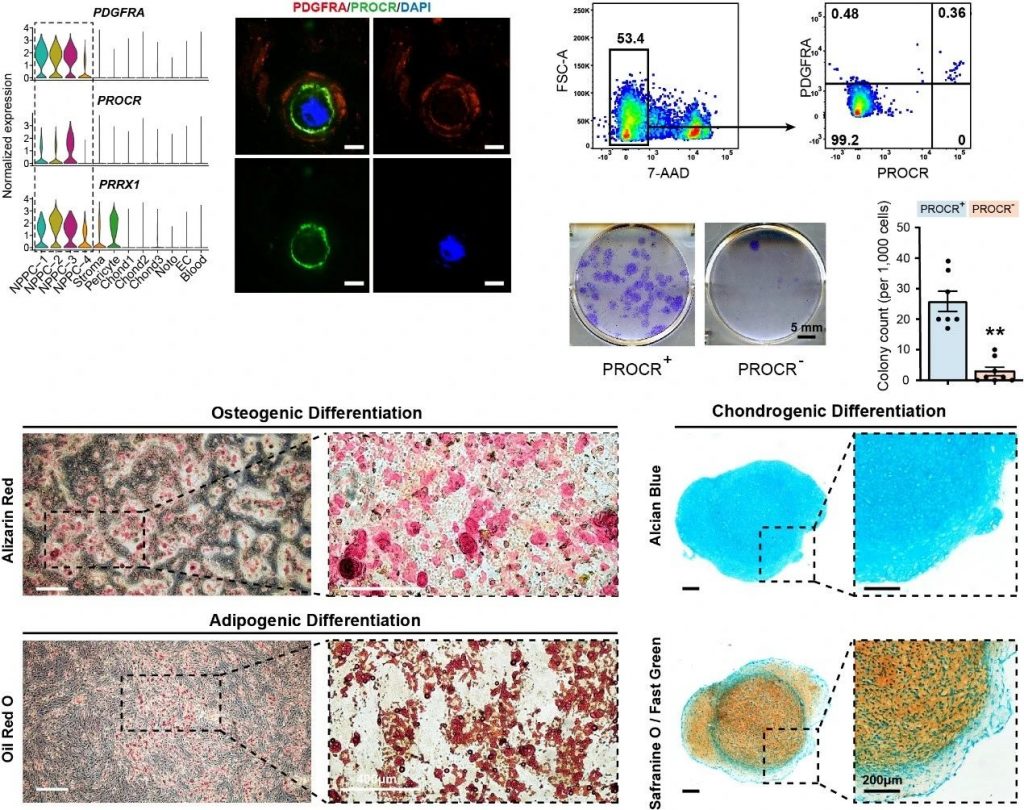
研究人员还发现,祖细胞亚群特异性高表达间充质祖细胞标记物PDGFRA和中胚层来源间充质标志物PRRX1,并且主要存在于髓核组织中,提示髓核内可能存在具有干性潜能的细胞群体。进一步深入分析,发现了其中一个髓核祖细胞亚群高度表达干性基因PROCR,并富集了软骨生成相关的重要转录因子SMAD3。运用免疫荧光染色证实了PROCR+细胞内p-SMAD3高度活化。随后,研究人员运用细胞表面标志物PROCR富集了髓核祖细胞群体,发现该细胞群具有较强的体外克隆形成能力。与Monocle 3拟时序分析一致,体外实验证实PROCR+细胞具有成骨、成软骨和成脂三系分化潜能。
该研究工作得到了陆军特色医学中心军事医学培养计划、国家自然科学基金、重庆市博新计划、创伤烧伤复合伤国家重点实验室优青基金等多个基金项目的资助,陆军军医大学陆军特色医学中心(大坪医院)骨科刘鹏副教授与解放军总医院第五医学中心刘兵研究员为该论文的共同通讯作者,甘翼搏博士后与贺健博士为论文的共同第一作者,陆军特色医学中心为第一完成单位。该工作也得到了陆军特色医学中心陈林教授课题组的参与和支持。
